In chimica, il termine "diluzione infinita" è un concetto applicato allo studio di solventi e soluti (le sostanze disciolte in solventi). È un metodo di estrapolazione, utilizzato per verificare se una determinata proprietà di una soluzione proviene dal soluto. La natura esoterica del test contrasta con la notorietà che ha ricevuto negli ultimi decenni a causa della sua cattiva applicazione occasionali nel campo della medicina omeopatica.
Strategia
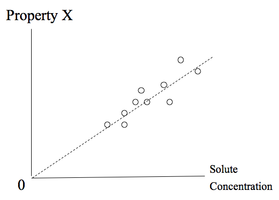
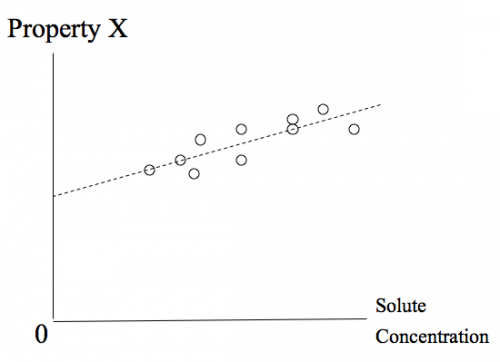
Diluzione infinita è un test per estrapolazione, non un concetto fisico. Il soluto non è effettivamente ridotto a concentrazione zero, per alcuni motivi pratici. Invece, un'estrapolazione, o limite, dipende dai punti di dati di varie concentrazioni di soluto per vedere se alcune proprietà specificata svanirebbero a zero concentrazione del soluto. Se lo fa, allora la proprietà è causata da soluto. In caso contrario, è preso come prova che l'effetto osservato è dovuto a qualcosa di diverso da quello specifico soluto.
Alcune definizioni
Alcune definizioni per diluzione infinita sono state proposte in letteratura. Si dichiara che la diluzione infinita è il particolare comportamento di una miscela di due-sostanza quando la concentrazione di un componente si avvicina al limite di 0 e gli altri approcci una frazione molare di 1 (il secondo componente è il solvente).
Un'altra definizione è: quel particolare comportamento quando la miscela è sufficientemente diluita che soluto-soluto interazioni sono trascurabili.
Ruolo nella ricerca di una Base di calcolo
Oltre a testare se un soluto svolge un ruolo in alcune proprietà, il metodo di diluizione infinita può essere utilizzato per un paio di altri motivi.
Ad esempio, la solubilità del gas è dipende dalla pressione e temperatura. Determinando la solubilità del gas nel limite come la concentrazione del soluto va a zero, una lettura di base indipendente di pressione e di temperatura di solubilità del gas può essere determinata. La base può quindi essere modificata per pressione-temperatura-dipendenza e a concentrazioni più elevate. L'uso di una serie di fattori di modifica di base e separata in realtà semplifica i calcoli.
Ricerca anche è fatto nella gamma di diluzione infinita, vale a dire, a basse concentrazioni, poiché la gamma è significativa in diversi settori industriali. Ad esempio, nel settore ambientale, rimozione di tracce di inquinamento può richiede conoscenza dei comportamenti di soluzione a basse concentrazioni. Purificazione nell'industria farmaceutica richiede anche la conoscenza del comportamento in questa gamma. L'industria della gomma è interessato nel comportamento dei solventi in uscita da polimeri.
Questioni procedurali
Ma perché usare diluzione infinita a tutti? Perché non basta provare un solvente, senza soluto in essa disciolti?
In alcuni casi, più di un soluto è presente. Ma allora perché non basta preparare un solvente con solo gli altri soluti? Perché gli altri soluti stessi possono trasformarsi in detto soluto, per raggiungere l'equilibrio dinamico. In altre parole, essi possono essere su lati opposti della stessa equazione chimica. Molto poche reazioni chimiche procedano in un'unica direzione; maggior parte delle reazioni sono reversibile. Appena qualche forma di molecole di prodotto, la reazione inversa comincia a prendere posto. O gli altri soluti possono essere necessari in qualche modo.
Il punto di un esperimento non siano anche per determinare il comportamento al limite di diluizione, ma invece per determinare una base di calcolo, come accennato in precedenza.
A volte è semplicemente auspicabile per essere in grado di identificare ed eliminare quindi il rumore di fondo da interazioni solvente-solvente e altra fonte per sottrarre fuori da calcoli successivi di soluto comportamento.
Nel complesso, l'idea generale è che la situazione è sufficientemente complessa che l'eliminazione di un singolo soluto non è un'analisi sufficiente. Un esempio riportato di seguito viene illustrata una tal complicazione.
Uso improprio
All'interno della comunità di ricerca chimica, concetti sottili sono a volte non adeguatamente affrontati, ad esempio, un uso eccessivo di estrapolazione per determinare la natura dei comportamenti di basso-concentrazione o presuntuoso interazione trascurabile agli ioni ad una concentrazione non sufficientemente bassa.
Gli abusi di diluzione infinita ricevendo attenzione nei media, tuttavia, centro intorno alla comunità omeopatica. Per oltre un secolo, i membri della comunità omeopatica sono venduti diluizioni dei veleni, guidati dalla "legge dei simili": ciò che produce sintomi in una persona sana in grado di curare una persona malata con i sintomi. Numerose diluizioni sono stati trovati per ridurre gli effetti collaterali, senza ridurre l'efficacia della sostanza. (Passati e attuali praticanti a volte diluire il veleno tanto da superare quello che viene chiamato il limite di diluizione, il punto in cui è improbabile che tutte le molecole della sostanza originale rimangono---letteralmente una diluzione infinita!)
La differenza dal metodo di diluizione infinita in chimica---a parte fisicamente diluire anche oltre il limite di diluizione, rispetto all'utilizzo di estrapolazione---è che questi professionisti credono che Costanza di beneficio dopo diluizione pesante significa il solvente acqua/alcool "imparato" proprietà dell'ingrediente di veleno/attivo. Un chimico concluderebbe il contrario: che il principio attivo non ha avuto un beneficio, e che una ricerca della fonte del beneficio sarebbe possibile trovare altrove, ad esempio, il solvente, alcune impurità o l'effetto placebo. L'incapacità di quelli fuori l'omeopatia per replicare i risultati positivi di tali pozioni suggerisce una quarta possibilità.