Gli atomi sono composti da un nucleo pesante circondato da elettroni leggeri. Il comportamento degli elettroni è governato dalle regole della meccanica quantistica. Tali regole consentono di elettroni ad occupare regioni specifiche chiamate orbitali. Le interazioni di atomi sono quasi esclusivamente attraverso i loro elettroni più esterne, quindi la forma di tali orbitali diventa molto importante. Ad esempio, quando gli atomi sono portati vicino a vicenda, se loro ultraperiferiche orbitali si sovrappongono quindi possono creare un forte legame chimico; così qualche conoscenza della forma degli orbitali è importante per comprendere le interazioni atomiche.
Numeri quantici e orbitali
I fisici hanno trovato conveniente usare la sintassi abbreviata per descrivere le caratteristiche degli elettroni in un atomo. La stenografia è in termini di numeri quantici; questi numeri possono essere solo numeri interi, le frazioni non. Il numero quantico principale, n, è relativo all'energia dell'elettrone; poi c'è il numero quantico orbitale, l e il numero quantico del momento angolare, m. Ci sono altri numeri quantici, ma essi non sono direttamente correlate alla forma degli orbitali. Orbitali sono non orbite, nel senso di essere percorsi intorno al nucleo; invece, essi rappresentano le posizioni dove l'elettrone è più probabilità di essere trovati.
Orbitali S
Per ogni valore di n, c'è un orbitale dove sia l e m sono uguali a zero. Tali orbitali sono sfere. Maggiore è il valore di n, il più grande della sfera — cioè, il più probabile è che l'elettrone si trova più lontano dal nucleo. Le sfere non sono altrettanto dense in tutto; Essi sono più simili a conchiglie nidificati. Per ragioni storiche, questo è chiamato un s orbitale. A causa delle regole della meccanica quantistica, gli elettroni di energia più bassi, con n = 1, necessario sia l e m è uguale a zero, così l'unico orbitale che esiste per n = 1 è l'orbitale s. L'orbitale s esiste anche per ogni altro valore di n.
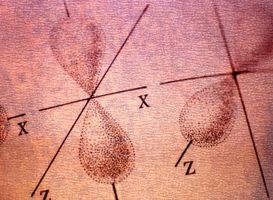
Orbitali P
Quando n è maggiore di uno, più possibilità si aprono. L, il numero quantico orbitale, può avere qualsiasi valore fino a n-1. Quando l è uguale a uno, l'orbitale è chiamato un p orbitale. Gli orbitali P simile tipo di manubri. Per ogni l, m va da positivo a negativo l in passi di uno. Così, per n = 2, l = 1, m può uguale 1, 0 o -1. Ciò significa che ci sono tre versioni del orbital p: uno con il manubrio alto e in basso, un altro con il manubrio sinistro-destro e un altro con il manubrio ad angolo retto per gli altri due. Gli orbitali P esistano per tutti i principali numeri di quantum maggiori di uno, anche se essi hanno struttura aggiuntiva come n diventa più alto.
Orbitali D
Quando n = 3, poi l può essere uguale 2 e quando l = 2, m può uguale 2, 1, 0, -1 e -2. L = 2 orbitali sono chiamati orbitali d e ce ne sono cinque differenti corrispondenti a diversi valori di m. La n = 3, l = 2, m = 0 orbitale assomiglia anche a un manubrio, ma con una ciambella intorno alla metà. Gli altri orbitali d quattro simile a quattro uova impilate su fine in uno schema quadrato. Le diverse versioni sono solo le uova puntando in direzioni diverse.
Orbitali F
La n = 4, l = 3 orbitali sono chiamati orbitali f, e sono difficili da descrivere. Hanno caratteristiche più complesse. Ad esempio, la n = 4, l = 3, m = 0; m = 1; e m =-1 orbitali sono modellati come manubri nuovamente, ma ora con due guarnizioni di gomma piuma tra le estremità del bilanciere. Gli altri valori di m Guarda un po' come un fascio di otto palloncini, con tutti i loro nodi legati insieme al centro.
Effetti grafici
La matematica che regola gli orbitali di elettrone è abbastanza complessa, ma ci sono molte risorse online che forniscono le realizzazioni grafiche degli orbitali diversi. Questi strumenti sono molto utili nel visualizzare il comportamento degli elettroni nei dintorni di atomi.