Una formula chimica esprime la composizione chimica di un composto utilizzando simboli chimici. Questo viene fatto assegnando un significato speciale per apici e pedici. Alcune molecole sono così simili che condividono la stessa formula chimica. Pertanto, sono state sviluppate diverse forme di formule chimiche per facilitare questa distinzione, tra cui la rappresentazione pittorica.
Come E = mc ^ 2 in fisica, alcune formule chimiche sono conosciute in tutto il mondo. H2O, CO2 e HCl sono probabilmente i più riconosciuti.
Sostanze giornalieri
Di sostanze giornalieri, il simbolo dell'acqua, H2O, è probabilmente il più noto. Sale da tavola (NaCl) potrebbe essere il prossimo, lontano davanti le relative al base di idrossido di sodio (NaOH). Ammoniaca (NH3) e metano (CH4) sono ben noti rispettivamente come un detergente e un combustibile gassoso. Lo zucchero da tavola, o glucosio, è C6H12O6. E l'aria è una miscela di diversi gas, gas biatomico principalmente azoto (N2), gas di ossigeno biatomico (O2) e un po ' anidride carbonica (CO2), più alcuni altri gas in tracce. Monossido di carbonio (CO), anche se ampiamente conosciuto, non è una sostanza tutti i giorni, dal momento che è letale in ambienti chiusi. Perossido di idrogeno, utilizzato come disinfettante e di candeggina capelli, è H2O2. C9H8O4 è la formula chimica per l'aspirina.
Acidi comuni
Alcuni comuni acidi e loro formule chimiche sono i seguenti: acido cloridrico (HCl); acido nitrico (HNO3); acido cianidrico (HCN); acido perclorico (HClO4); acido solforico (H2SO4); e acido carbonico (H2CO3).
Come facilmente un acido trasferisce un protone all'acqua determina la forza di un acido. Si può presumere che gli acidi sopra con due atomi di idrogeno a rinunciare sono i più forti. L'acido solforico è infatti un acido forte, ma l'acido perclorico è il più forte qui elencati. Acido carbonico può essere un debole o un acido forte, a seconda della pressione parziale di anidride carbonica (CO2) nell'aria sopra la soluzione.
Prodotti chimici comuni nelle notizie
I radicali liberi e l'ozono sono alcuni prodotti chimici comuni nelle notizie. L'ozono, un gas tossico di azzurro che ci protegge assorbendo la luce ultravioletta (UV) dallo spazio, ha una formula chimica di O3. Quando la UV colpisce, scinde in diossigeno (O2) e un atomo di ossigeno libero (O).
I radicali liberi sono frammenti molecolari avendo uno o più elettroni spaiati. Gli elettroni accoppiati sono più stabili di elettroni spaiati, così i radicali liberi sono di breve durata e altamente reattivi. Pertanto possono alterare la struttura dei composti organici e danneggiare la salute. Superossido (O2-) è un potente del radicale libero creato nel normale processo di metabolismo. Il radicale ossidrile (HO) è un radicale libero prodotto quando degrada il perossido di idrogeno (H2O2). Un segno negativo viene utilizzato per indicare una carica negativa netta.
Più tipi di formule chimiche
Quando la gente pensa di formule chimiche, pensano di CO2 e H2O. Questi sono denominati formule chimiche molecolari. Essi mostrano l'esatto numero e tipo di atomi in una molecola. Ci sono però altri due tipi: formule empiriche e formule strutturali.
Formule empiriche dare il tipo di atomi presenti e il rapporto tra di loro, ma non il numero effettivo di atomi per molecola. Ad esempio, la formula empirica del glucosio non è C6H12O6 ma invece CH2O. Se trasmette meno informazioni, qual è il punto di questa forma? Struttura della molecola può non essere distinguibile, ma i rapporti degli atomi in essa possono essere empiricamente determinabili. Così il meglio che può essere registrato è il rapporto tra gli elementi.
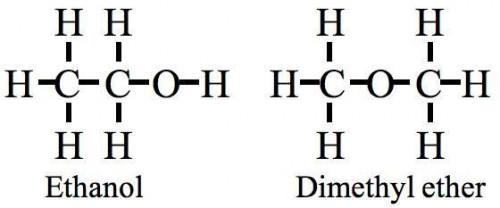
La formula molecolare di due molecole può essere lo stesso. Ad esempio, la formula molecolare per i comune prodotti chimici etanolo e dimetil etere è C2H6O. Pertanto, una formula strutturale per distinguere i due è auspicabile. (Si noti che ogni barra nell'immagine rappresenta una coppia di elettroni).
Forma dell'isotopo
Altre sostanze ben note si distinguono dalla loro struttura nucleare anziché la loro struttura di elettroni, ad esempio uranio-238 o carbonio-14. Formule chimiche hanno una certa forma di distinguere gli isotopi. Mentre il lato destro di un elemento chimico è per etichettare carica conteggio e conteggio di atomo, il lato sinistro è riservato per protone e neutrone totali. L'apice a sinistra dà la somma di protoni e neutroni, mentre l'indice a sinistra dare il numero di protoni.