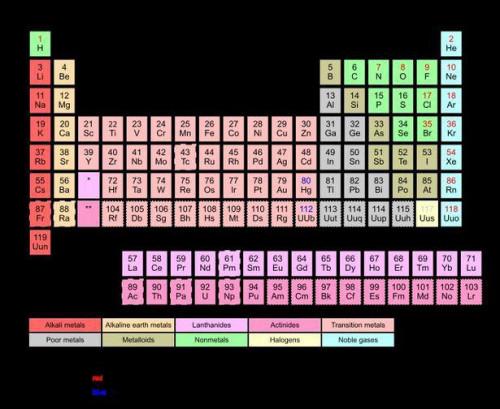
La tavola periodica è un indice dettagliato degli elementi noti al genere umano. La caratteristica più elegante di questa tabella è relativo raggruppamento e l'organizzazione degli elementi che li inserisce ordinatamente secondo il numero atomico e gruppo. La tavola periodica fu creata per dimostrare i "periodi" osservati negli elementi.
Storia
Il credito per l'invenzione della tavola periodica va a Dmitri Mendeleev nel 1869, anche se altri tavoli elementare hanno predati esso. Questa tabella è stata effettuata per mostrare certe tendenze all'interno degli elementi ed è stata organizzata in modo tale che rappresenta visivamente tali tendenze "periodiche". A partire dal 2009, la tavola periodica contiene 117 elementi. Alcuni di questi elementi sono stati creati sinteticamente di acceleratori di particelle, mentre 94 di essi si trovano naturalmente sulla terra.
Organizzazione
La tavola periodica è organizzata principalmente in una griglia-come la moda di periodi (righe) e gruppi (colonne). La più importante è gruppi, in cui è possibile osservare un modello generale di caratteristiche simili di ogni elemento contenuto all'interno di ogni gruppo. Ad esempio, tutti i gas nobili (Elio, neon, argon e altri) sono tutti nella stessa colonna. Ogni elemento nella tabella è elencato consecutivamente dal numero atomico. È il numero atomico rappresenta la quantità di protoni nel nucleo di un atomo di un particolare elemento.
Perché è stato scelto tabella di Mendeleev
C'erano un numero di tavoli elementare nel corso della storia, ma solo uno è diventato ampiamente accettato anche a questo giorno. Tavola periodica di Dmitri Mendeleev migliore illustrati tutti gli elementi con le loro proprietà chimiche. Tuttavia, non era solo questo che lo ha reso di successo. Sua stanza di sinistra di tabella per gli elementi che non sono stati ancora scoperti. La tavola periodica degli elementi è una tabella modificabile che non ha bisogno di essere completamente rinnovato al momento della scoperta di un nuovo elemento. Questa scalabilità ha reso un modello per profilo elementare dal 1869.
Periodi
Le righe della tavola periodica sono conosciute come periodi. Loro importanza è sminuito dall'importanza dei gruppi, anche se periodi ancora avere qualche terreno su come si costruisce la tavola periodica. Un nuovo periodo si verifica dopo ogni gas nobile. L'importanza dei periodi di avvio che si verificano nella parte inferiore della tabella, quando i lantanoidi e attinidi cominciano ad apparire, dato che la maggior parte di loro hanno proprietà simili. Questa parte della tabella è separata dal resto per preservare la sua composizione.
Reattività in gruppi
I gruppi elementari nella tavola periodica ci mostrano più di solo chimica proprietà di ogni elemento. Ogni gruppo vengono visualizzati elementi che rivestono anche la stessa tendenza reattiva. In altre parole, ogni elemento viene inserito nella tabella periodica secondo quanto reattiva saranno. Metalli alcalini e alogeni tendono ad essere più reattiva perché hanno un solo elettrone, o manca un elettrone, nel loro guscio più esterno. I gas nobili presso l'ultimo gruppo della tavola periodica sono i più inerti poiché hanno un set completo di elettroni nel loro guscio più esterno.