Ioni poliatomici sono costituiti da due o più atomi legati in modo covalente e hanno una carica netta. Ioni poliatomici che contengono ossigeno sono denominati oxyanions pesanti. È una buona idea avere familiarità con ioni poliatomici comuni poiché li incontrerai frequentemente. Se avete già strutture di Lewis dot e VSEPR nel vostro corso di chimica, potete disegnare strutture di Lewis dot per questi ioni e prevedere le loro forme utilizzando le loro formule molecolari.
Ione ammonio
Lo ione ammonio è un acido debole e l'acido coniugato dell'ammoniaca. La sua formula molecolare è NH4 +. È tetraedrica nella forma con quattro atomi di idrogeno disposti simmetricamente intorno l'atomo di azoto centrale e ha una carica netta pari a + 1. Come regola generale, composti di ammonio sono in genere solubili in acqua.
Ioni solfato/solfito
Lo ione solfato ha la formula molecolare SO4 con una netta carica-2, mentre lo ione solfito ha una formula molecolare di SO3 e una netta carica-2. Lo ione solfato è tetraedrico nella forma, mentre lo ione solfito ha una forma piramidale trigonale. Composti ionici con solfati sono in genere solubili in acqua, con l'eccezione del calcio, stronzio, bario, piombo, mercurio e argento. Lo ione solfato è la base coniugata dello ione idrogeno solfato, che è la base coniugata di acido solforico.
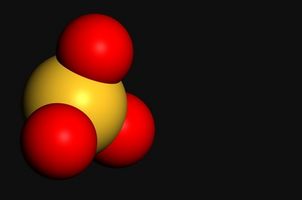
Fosfato
Lo ione fosfato ha la formula molecolare PO4 e una carica netta di -3. Esso è tetraedrica nella forma ed è la base coniugata di un acido polyprotic, acido fosforico. Composti ionici dei fosfati sono generalmente insolubile in acqua, ad eccezione dei composti con il gruppo 1 elementi (metalli alcalini) e fosfato di ammonio. Gruppi fosfato sono particolarmente importanti in biochimica; la spina dorsale del DNA è formata da una catena di zucchero-fosfato e sintesi di trifosfati del nucleoside sono un modo importante per le cellule memorizzare e raccogliere l'energia.
Ioni del nitrato/nitrito
Lo ione nitrato ha la formula molecolare NO3, mentre lo ione nitrito ha la formula molecolare NO2. Entrambi gli ioni hanno una carica netta pari a -1. Nitrati e nitriti sono solubili in acqua come una regola generale. Lo ione nitrato ha una forma trigonale planare, mentre lo ione nitrito ha una forma angolare o piegata; in entrambi i casi l'atomo di azoto è l'atomo centrale.
Clorati e perclorati
Ci sono quattro oxyanions pesanti che contengono cloro, vale a dire comuni, ipoclorito, clorite, clorato e perclorato. Sono loro le formule molecolari (ClO)-, (ClO2) -2, (ClO3) -3 e (ClO4) -4, rispettivamente. Ipoclorito ha una carica di-1, clorite ha una carica-2, clorato ha una carica di-3 e perclorato ha una carica di-4. Come regola generale, composti ionici formati da questi ioni sono in genere solubili in acqua.